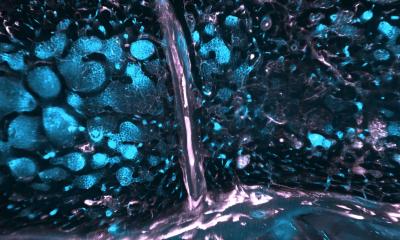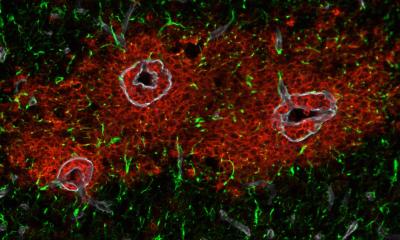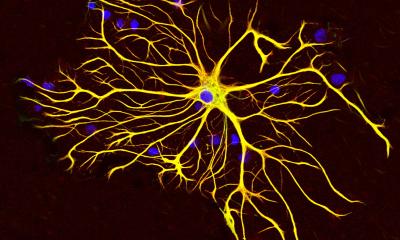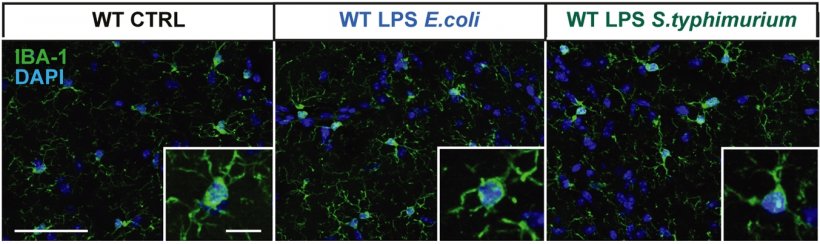
Bildnachweis: Marianna Beyer/TU Braunschweig
News • Wenn das Immunsystem überreagiert
Sepsis kann dem Gehirn langfristig schaden
Infektionen können eine besonders heftige Immunreaktion des Körpers auslösen. Bei einer solchen Sepsis reagiert das Immunsystem so stark, dass nicht nur die Krankheitserreger, sondern auch Gewebe und Organe geschädigt werden.
Forscher der Technischen Universität Braunschweig konnten in einer Studie mit Mäusen zeigen, dass eine Sepsis auch nach der Genesung noch langfristige Auswirkungen auf das Gehirn und das Lernverhalten haben kann. Eine Hemmung des Proteinkomplex NLRP3 könnte diese negativen Auswirkungen verhindern. Die Studie wurde jetzt im Fachmagazin Journal of Neuroscience veröffentlicht. Beteiligt waren auch das Deutsche Zentrum für Neurodegenerative Erkrankungen und die Universität Bonn.
Neuroinflammation, also entzündliche Prozesse im Gehirn, spielen auch bei einer Sepsis eine große Rolle
Martin Korte
Mikrogliazellen sind Immunzellen im Gehirn und gehören zum angeborenen menschlichen Immunsystem. Wenn Krankheitserreger das Gehirn befallen, aktivieren sie spezielle Proteinkomplexe, so genannte Inflammasome. Diese lösen eine Neuroinflammation aus, eine entzündliche Reaktion im Gehirn, um die Krankheitserreger unschädlich zu machen. In der Regel endet diese Reaktion mit dem Gesundwerden. „Neuroinflammation, also entzündliche Prozesse im Gehirn, spielen auch bei einer Sepsis eine große Rolle. Das ist der Ausgangspunkt für unsere Studie gewesen. Wir haben die langfristigen Auswirkungen einer Sepsis auf das Gehirn von Mäusen untersucht, und welchen Einfluss dabei das Inflammasom NLRP3 hat. Das wurde bisher so noch nicht erforscht“, sagt Professor Martin Korte, Neurobiologe am Institut für Zoologie der TU Braunschweig und Leiter der Arbeitsgruppe „Neuroinflammation und Neurodegeneration“ am Helmholtz-Zentrum für Infektionsforschung (HZI).
Die Wissenschaftler konnten zeigen, dass eine Sepsis eine chronische Entzündung des Gehirns verursachen und so langfristige negative Konsequenzen haben kann. Um das zu untersuchen hat das Team um Professor Korte zusammen mit Professor Heneka aus Bonn eine Studie mit Mäusen gemacht. Den Tieren wurden Bestandteile der Zellmembran von Bakterien injiziert, um eine Sepsis auszulösen. Nach drei Monaten haben sich die Wissenschaftler dann die Gehirne und das Lernverhalten der Tiere angeschaut: Dabei zeigte sich, dass ihre Nervenzellen weniger Synapsen hatten und die synaptische Plastizität eingeschränkt war, also die Fähigkeit ihrer Synapsen, sich als Voraussetzung zum Lernen verstärken zu können. Dadurch lernten die Tiere im Verhaltenstest schlechter als die Kontrollgruppen. „Wir konnten zeigen, dass die Folgen einer Sepsis auch drei Monate später noch im Gehirn zu sehen sind. Das Besondere an unserer Studie ist, dass wir junge und ältere Mäuse miteinander verglichen haben. Dadurch haben wir gesehen, dass die Folgen einer Neuroinflammation durch eine Sepsis bei älteren Mäusen nach drei Monaten noch deutlich stärker zu sehen sind als bei jüngeren Mäusen“, sagt Niklas Lonnemann, der zusammen mit Marianna Beyer einer der Erstautoren der Publikation ist.
Das Forscherteam vermutete, dass die entzündlichen Reaktionen im Gehirn der Mäuse durch das Inflammasom NLRP3 ausgelöst werden. In einem nächsten Schritt haben sie deshalb so genannte Knockout-Mäuse verwendet, die kein NLRP3-Molekül produzierten, und haben bei weiteren Mäusen das NLRP3 mit Wirkstoffen akut gehemmt. Auch die Gehirne dieser Mäuse untersuchten sie 3 Monate nach einer überstandenen Sepsis.
Das Gehirn der Alzheimer-Mäuse scheint aufgrund der Erkrankung schon auf entzündliche Prozesse geprimt, also voreingestellt zu sein und deshalb vermutlich schneller und stärker darauf anzuspringen
Martin Korte
Das Ergebnis: Ohne das NLRP3 entstanden keine chronischen Entzündungen im Gehirn. Dadurch hatte die Sepsis auch keine negativen Auswirkungen auf das Lernverhalten der Tiere. „Wenn das Inflammasom NLRP3 inaktiviert ist, sieht man im Tiermodell deutlich, dass das positive Konsequenzen für das Gehirn hat. Das Risiko, dass das Gehirn erkrankt, steigt scheinbar aber nicht. Das Immunsystem hat offensichtlich noch andere Signalwege, um mit den Erregern fertig zu werden“, sagt Martin Korte. „Das sind extrem spannende Ergebnisse. Sie eröffnen Möglichkeiten für eine therapeutische Behandlung mit Wirkstoffen, die gezielt das NLRP3 hemmen und so mögliche negative Konsequenzen für das Gehirn verhindern, ohne das Immunsystem im Ganzen einzuschränken.“
Das Inflammasom NLRP3 spielt bei verschiedenen Entzündungsreaktionen eine Rolle, vermutlich auch bei der Alzheimer-Krankheit. Deshalb haben die Wissenschaftler auch die langfristigen Auswirkungen einer Sepsis auf das Gehirn von Mäusen untersucht, die Symptome ähnlich denen von Alzheimer-Patienten entwickeln. „Ältere Mäuse mit teilweise vorhandener Alzheimer-Symptomatik waren von der immunologischen Reaktion durch NLRP3 noch stärker betroffen als die älteren Mäuse ohne die Alzheimer-Symptome“, sagt Martin Korte. „Das Gehirn der Alzheimer-Mäuse scheint aufgrund der Erkrankung schon auf entzündliche Prozesse geprimt, also voreingestellt zu sein und deshalb vermutlich schneller und stärker darauf anzuspringen. Das könnte auch eine mögliche Erklärung dafür sein, warum Patientinnen und Patienten in Altenheimen so stark von COVID-19 betroffen sind, da bei einer solchen Infektion ähnliche immunologische Reaktionen im Gehirn wie bei einer Sepsis hervorgerufen werden.“
Quelle: TU Braunschweig
26.06.2020